
Вариант 4
Задание №1.
На данном рисунке изображена модель атома
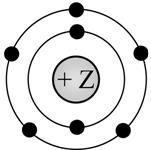
1. Фтора
2. Азота
3. Бора
4. Углерода
Объяснение: атом элемента, представленного на картинке имеет два электронных слоя. На первом слое 2 электрона, на втором - 5. Значит этот элемент находится во втором периоде в пятой группе. Это - азот. Правильный ответ - 2.
Задание №2.
В каком ряду химических элементов ослабевают неметаллические свойства соответствующих им простых веществ?
1. Кислород → сера → селен
2. Алюминия → фосфор → хлор
3. Углерод → азот → кислород
4. Кремний → фосфор → сера
Объяснение: неметаллические свойства ослабевают в периоде справа налево и в группе сверху вниз. Находим такую зависимость - это ряд от кислорода до селена. Правильный ответ - 1.
Задание №3.
Ковалентной полярной связью образован:
1. Сульфид кальция
2. Оксид калия
3. Сероводород
4. Водород
Объяснение: ковалентная полярная связь образуется между двумя неметаллами, как в сероводороде. Правильный ответ - 3.
Задание №4.
В порядке уменьшения валентности в водородных соединениях элементы расположены в ряду:
1. Si → P → S → Cl
2. F → N → C → O
3. Cl → S → P → Si
4. O → S → Se → Te
Объяснение: в первом варианте ответа элементы расположены в порядке уменьшение валентности водорода в их водородных соединениях:
SiH4 (IV) → PH3 (III) → H2S (II) → HCl (I)
Правильный ответ - 1.
Задание №5.
К амфотерным оксидам относится каждое из двух веществ:
1. Оксид железа (II) и оксид железа (III)
2. Оксид азота (IV) и оксид азота (II)
3. Оксид цинка и оксид хрома (III)
4. Оксид фосфора (V) и оксид бора (III)
Объяснение: амфотерные оксиды - оксиды переходных металлов. Посмотреть свойства амфотерных оксидов можно тут. Из перечисленных оксидов к амфотерным относят оксид цинка и оксид хрома (III). Правильный ответ - 3.
Задание №6.
Уравнение реакции нейтрализации:
1. CaO + 2HCl = CaCl2 + H2O
2. Ba(NO3)2 + K2SO4 = BaSO3 + 2KNO3
3. HNO3 + KOH = KNO3 + H2O
4. ZnSO4 + 2NaOH = Zn(OH)2 + Na2SO4
Объяснение: реакция нейтрализации проходит между основанием и кислотой, в результате получается соль и вода. Под данное описание подходит вариант ответа 3. Правильный ответ - 3.
Задание №7.
В перечне ионов
А. Нитрат-ион
Б. Ион аммония
В. Гидроксид-ион
Г. Ион водорода
Д. Фосфат-ион
Е. Ион магния
катионами являются:
1. БГД 2. БГЕ 3. АГЕ 4. ВГЕ
Объяснение: катионы - ионы металлов, водорода или аммония (и многие другие). В данном случае выберем: ион аммония, ион водорода и ион магния, то есть БГД. Правильный ответ - 1.
Задание №8.
Осадок образуется при взаимодействии:
1. CaCO3 и H2SO4
2. Ca(OH)2 и CO2(изб)
3. Na2CO3 и HNO3
4. Ca(OH)2 и CO2(недост)
Объяснение:
1. В первой реакции образуется углекислый газ и малорастворимый сульфат кальция.
2. Ca(OH)2 + CO2(изб) = СаСО3↓ + Н2О
3. Na2CO3 и 2HNO3 = 2NaNO3 + H2O + CO2↑
4. Ca(OH)2 и CO2(недост) = Са (НСО3)2
Осадок образуется во второй реакции. Правильный ответ - 2.
Задание №9.
Сера является окислителем в реакции, уравнение которой:
1. Zn + S = ZnS
2. 2SO2 + O2 = 2SO3
3. H2O + SO3 = H2SO4
4. S + O2 = SO2
Объяснение: определим изменения степеней окисления серы в каждой реакции.
1. (0) +2е → (-2) - окислитель
2. (+4) -2е → (+6) - восстановитель
3. (+6) → (+6) - нет изменения степени окисления
4. (0) -4е → (+4) - восстановитель
Правильный ответ - 1.
Задание №10.
Среди веществ, формулы которых C, FeO, NaOH - в реакции с оксидом углерода (II) вступает(-ют):
1. Только NaOH
2. Только FeO
3. C и FeO
4. NaOH и FeO
Объяснение: углерод не реагирует с монооксидом углерода, как и гидроксид натрия. А оксид железа (II) реагирует:
FeO + CO = Fe + CO2
Правильный ответ - 2.
Задание №11.
С гидроксидом железа (III) будет взаимодействовать вещество, формула которого:
1. CuSO4
2. BaCl2
3. CaO
4. HNO3
Объяснение: гидроксид железа является амфотерным гидроксидом и из представленных веществ с ним реагирует только азотная кислота, происходит реакция нейтрализации, в ходе которой образуется нитрат железа (III) и вода. Правильный ответ - 4.
Задание №12.
С каждым из веществ: сероводородная кислота, гидроксид калия, цинк - взаимодействует вещество, формула которого:
1. Pb(NO3)2
2. Na2SO3
3. KBr
4. MgCl2
Объяснение: среди перечисленных веществ цинк может прореагировать только с нитратом свинца, так как цинк, как металл, сильнее свинца. Запишем все реакции.
H2S + Pb(NO3)2 = PbS↓ + 2HNO3
2KOH + Pb(NO3)2 = 2KNO3 + Pb(OH)2↓
Zn + Pb(NO3)2 = Zn(NO3)2 + Pb
Правильный ответ - 1.
Задание №13.
Верны ли следующие суждения об оксидах углерода?
А. Оксид углерода (IV) ядовит.
Б. Оксид углерода (II) вызывает отравление организма.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: СО2 не ядовит, в отличие от монооксида углерода - угарного газа. Правильный ответ - 2.
Задание №14.
В уравнении окислительно-восстановительной реакции
NO2 + Mg → MgO + N2
коэффициент перед формулой окислителя равен
1. 4
2. 3
3. 2
4. 1
Объяснение: запишем баланс.
2N(+4) +8e → N2(0) | 1 - окислитель
Mg(0) -2e → Mg(+2) | 4 - восстановитель
Расставляем коэффициенты.
2NO2 + 4Mg → 4MgO + N2
Перед окислителем стоит коэффициент 2.
Правильный ответ - 3.
Задание №15.
Какое распределение массовых долей элементов соответствует количественному составу сульфата аммония:
1. 49, 21, 6, 24%
2. 41, 24, 7, 28%
3. 49, 14, 4, 33%
4. 56, 12, 4, 28%
Объяснение: найдем массовые доли азота, водорода, серы и кислорода в сульфате аммония.
М((NH4)2SO4) = 18 х 2 + 32 + 64 = 132 г/моль
Ar(N) = 14 г/моль
Ar(H) = 1 г/моль
Ar(S) = 32 г/моль
Ar(O) = 16 г/моль
ω(N) = (14x2)/132 x 100% = 21%
ω(H) = 8/132 x 100% = 6%
ω(S) = 32/132 x 100% = 24%
ω(O) = (16x4)/132 x 100% = 49%
Правильный ответ - 1.
Задание №16.
Общим для фосфора и серы является
1. Наличие одинакового числа электронов на внешнем электронном слое их атомов
2. Существование соответствующих им простых веществ в виде двухатомных молекул
3. Образование ими в высшей степени окисления кислотных оксидов
4. То, что в реакциях они проявляют свойства, как окислителя, так и восстановителя
5. Что значение их электроотрицательности меньше, чем у кремния
Объяснение: фосфор и сера являются неметаллами, оба находятся в третьем периоде и имеют три электронных слоя. Но у фосфора на внешнем электронном слое 5 электронов, а у серы - 6. Они образуют кислотные оксиды, при этом находятся в высшей степени окисления - Р2О5 и SO3. А еще они проявляют свойства как восстановителя, так и окислителя, то есть как отдают, так и принимают электроны. Их электроотрицательность выше, чем у кремния. Правильный ответ - 34.
Задание №17.
Для ацетилена характерны следующие утверждения
1. Имеет атомы углерода, связанные тремя парами электронов
2. Не обесцвечивает бромную воду
3. Легко вступает в реакции присоединения
4. Не реагирует со сложными веществами
5. Является жидким при комнатной температуре веществом
Объяснение: формула ацетилена Н-С≡С-Н, то есть атомы углерода связаны тремя связями (тремя парами электронов). Среди этих связей 2π-связи и одна - σ, π-связи менее прочные и легко разрываются в реакциях присоединения воды, водорода, галогенов, галогенводородов. Правильный ответ - 13.
Задание №18.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
Вещества
А) HCl(р-р) и Ba(OH)2(р-р)
Б) K2SO4(р-р) и KBr
В) Al(OH)3 и NH3(р-р)
Реактив
1. Ba(NO3)2(р-р)
2. H2SiO3
3. NaOH(р-р)
4. Фенолфталеин
Объяснение: соляную кислоту и гидроксид бария различим фенолфталеином, так как кислота имеет кислотную среду (фенолфталеин бесцветный), а гидроксид бария - щелочную (фенолфталеин оранжевый). Сульфат и бром калия различим при помощи раствора нитрата бария, так как в реакции между сульфатом бария и нитратом бария образуется нерастворимый сульфат бария. Гидроксид алюминия и раствор аммиака различим при помощи раствора гидроксида натрия, в реакции между гидроксидами алюминия и натрия получается комплексная соль - тетрагидроксоалюминат натрия, а с аммиаком реакция не идет. Правильный ответ - 413.
Задание №19.
Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействоват.
Название вещества
А) Железо
Б) Оксид железа (III)
В) Сульфат железа (II)
Реагенты
1. BaCl2(р-р), NaOH(р-р)
2. HCl(р-р), O2
3. Al, H2SO4(разб)
4. H2SO4(конц), O2
Объяснение: железо реагирует с раствором соляной кислоты и с кислородом.
Fe + 2HCl = FeCl2 + H2
3Fe + 2O2 = Fe3O4
Оксид железа (III) реагирует с алюминием и разбавленной серной кислотой.
Fe2O3 + 2Al = Al2O3 + 2Fe
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
Сульфат железа (II) реагирует с хлоридом бария и гидроксидом натрия.
FeSO4 + BaCl2 = BaSO4↓ + FeCl2
FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
Правильный ответ - 231.
Задание №20.
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
Zn + H2SO4(конц) → ZnSO4 + H2S + H2O
Определите окислитель и восстановитель.
Объяснение: в данном окислительно-восстановительной реакции меняют степень окисления цинк и сера. Запишем баланс.
Zn(0) -2e → Zn(+2) | 4 - восстановитель
S(+6) +8e→ Zn(-2) | 1 - окислитель
Расставляем коэффициенты.
4Zn + 5H2SO4(конц) → 4ZnSO4 + H2S + 4H2O
Задание №21.
К 63 г 20%-ного раствора азотной кислоты прилили избыток раствора гидроксида натрия. Какова масса образовавшейся соли?
Объяснение: запишем уравнение реакции.
HNO3 + NaOH → NaNO3 + H2O
Найдем массу вещества азотной кислоты.
m(HNO3) = 63 x 0,2 = 12,6 г
Находим количество вещества азотной кислоты.
n(HNO3) = 12,6/63 = 0,2 моль
Количество вещества азотной кислоты равно количеству вещества нитрата натрия.
n(NaNO3) = n(HNO3) = 0,2 моль
Теперь можем посчитать массу нитрата натрия.
m(NaNO3) = 0,2 x (23 + 14 + 48) = 17 г
Ответ: масса образовавшейся соли 17 г.
Задание №22.
Даны вещества: PbO, O2, Fe, HNO3(), KOH, SO3. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид свинца (II). Опишите признаки проведения реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Объяснение: сначала получим сульфат свинца.
PbO + SO3 → PbSO4
Теперь получим гидроксид свинца (II).
PbSO4 + 2KOH → Pb(OH)2↓ + K2SO4
Запишем сокращенное ионное уравнение.
Pb²+ + 2OH‾ → Pb(OH)2↓
