
Вариант 2
Задание №1.
На приведенном рисунке
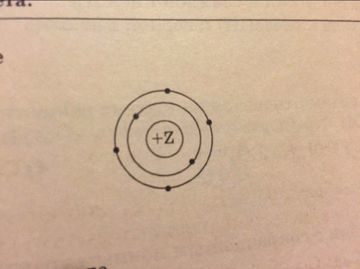
изображена модель атома
1. Кремния
2. Серы
3. Кислорода
4. Углерода
Объяснение: атом, модель которого приведена на рисунке, имеет два энергетических уровня, на первом уровне находится 2 электрона, а на втором - 4. Значит, это атом элемента №6 в Периодической таблице - углерод. Правильный ответ - 4.
Задание №2.
У химических элементов IVА группы периодической системы с увеличением относительной атомной массы:
1. Усиливаются металлические свойства и увеличивается валентность в водородных соединениях
2. Увеличиваются заряд ядра атома и радиус атома
3. Увеличиваются число электронных слоев в атоме и высшая валентность
4. Усиливаются неметаллические свойства и увеличивается число электронных слоев в атоме
Объяснение: у элементов одной группы валентность в водородных соединениях и высшая валентность. А заряд ядра атома и радиус атома в группе увеличиваются. Например, у углерода заряд ядра - +6, а у кремния - +14. Правильный ответ - 2.
Задание №3.
Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно:
1. Хлор и хлороводород
2. Вода и азот
3. Сероводород и метан
4. Кислород и оксид серы (IV)
Объяснение: ковалентная полярная связь характерна для соединений разных неметаллов, а ковалентная неполярная связь - для двухатомных неметаллов, поэтому выбираем воду и азот. Правильный ответ - 2.
Задание №4.
В веществах, формулы которых: CrO3, CrCl2, Cr(OH)3, хром проявляет степени окисления, соответственно равные:
1. +6, +2, +3
2. +6, +3, +2
3. +3, +2, +3
4. +3, +2, +6
Объяснение: CrO3 - кислород в оксидах имеет степень окисления -2, тогда у хрома - +6, CrCl2 - у хлора степень окисления -1, а у хрома - +2, Cr(OH)3 - у гидроксид-иона степень окисления степень окисления -1, а у хрома - +3. Правильный ответ - 1.
Задание №5.
К сложным веществам относится каждое из веществ, указанных в ряду
1. Углекислый газ, вода, азот, хлор
2. Поваренная соль, сахар, хлороводород, аммиак
3. Сероводород, кальций, хлор, метан
4. Серная кислота, фтор, оксид цинка, алюминий
Объяснение: сложные вещества состоят из атомов двух или более элементов, к ним относятся: поваренная соль, сахар, хлороводород, аммиак. Правильный ответ - 2.
Задание №6.
Образование газа происходит при сливании растворов:
1. Хлорида кальция и нитрата серебра
2. Азотной кислоты и гидроксида калия
3. Карбоната натрия и соляной кислоты
4. Гидроксида железа (III) и серной кислоты
Объяснение: выделение газа возможно при образовании угольной или сернистой кислоты или гидроксида аммония, угольная кислота образуется в третьей реакции. Запишем ее:
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
Правильный ответ - 3.
Задание №7.
К электролитам относится каждое из веществ, формулы которых:
1. N2O, KOH, Na2CO3
2. Cu(NO3)2, HCl, Na2SO4
3. Ba(OH)2, NH3xH2O, H2SiO3
4. CaCl2, Cu(OH)2, SO2
Объяснение: электролит - вещество, проводящее электрический ток при диссоциации на ионы. Сильными электролитами являются щелочи, сильные кислоты и соли. Правильный ответ - 2.
Задание №8.
В соответствии с сокращенным ионным уравнением
Al³+ + 3OH‾ = Al(OH)3
взаимодействует:
1. Сульфат алюминия и гидроксид бария
2. Нитрат алюминия и гидроксид калия
3. Оксид алюминия и гидроксид натрия
4. Фосфат алюминия и гидроксид кальция
Объяснение: данное сокращенное ионное уравнение возможно получить только при реакции, в которой единственным нерастворимым веществом является гидроксид алюминия. В первой реакции сульфат бария нерастворим, в третьей - оксид алюминия, в четвертой - фосфат кальция. Все нитраты и все соли калия растворимы, поэтому выбираем второе уравнение. Правильный ответ - 2.
Задание №9.
Железо вытесняет металл из раствора:
1. ZnCl2
2. Cu(NO3)2
3. Al2(SO4)3
4. Mg(NO3)2
Объяснение: железо может вытеснить только более слабый металл, среди перечисленных более слабым металлом является только медь. Правильный ответ - 2.
Задание №10.
Оксид калия взаимодействует с каждым из веществ, указанных в ряду
1. Вода, оксид углерода (II), серная кислота
2. Оксид бария, вода, гидроксид натрия
3. Вода, оксид углерода (IV), соляная кислота
4. Аммиак, кислород, азотная кислота
Объяснение: оксид бария - основный оксид, то есть взаимодействует с веществами с кислотными свойствами, такими, как оксид углерода (IV) и соляная кислота, а с водой с образованием гидроксида калия. Правильный ответ - 3.
Задание №11.
Нерастворимая соль образуется при взаимодействии растворов
1. Хлорида натрия и азотной кислоты
2. Хлорида магния и карбоната натрия
3. Хлорида меди (II) и гидроксида натрия
4. Хлорида алюминия и серной кислоты
Объяснение: в первой реакции образуется растворимая соль - нитрат натрия, во второй - карбонат магния (нерастворимый) и хлорид натрия (растворимый). В третьей - растворимый хлорид натрия, в четвертой - растворимый сульфат алюминия. Правильный ответ - 2.
Задание №12.
Раствор фосфата калия взаимодействует
1. С нитратом кальция
2. С азотной кислотой
3. С сульфатом аммония
4. С гидроксидом натрия
Объяснение: здесь должна пройти реакция обмена, она идет до конца только в случае образования осадка или газа. В первой реакции образуются нитрат калия (все нитраты растворимы) и фосфат кальция (осадок), значит реакция идет до конца. Правильный ответ - 1.
Задание №13.
При смешивании с воздухом взрывоопасным становится каждый из газов:
1. Оксид азота (II) и метан
2. Водород и оксид углерода (II)
3. Оксид серы (IV) и аммиак
4. Метан и водород
Объяснение: в состав воздуха входит кислород, при смешивании кислорода и водорода в определенном объеме происходит реакция со взрывом, а метан - очень энергоемкий газ и на воздухе сгорает с выделением большого количества тепла. Правильный ответ - 4.
Задание №14.
Сера является окислителем в реакции, уравнение которой:
1. 2SO2 + O2 = 2SO3
2. 2H2S + 3O2 = 2H2O + 2SO2
3. H2S + Br2 = 2HBr + S
4. 2Al + 3S = Al2S3
Объяснение: окислитель в окислительно-восстановительной реакции принимает электроны. Рассмотрим изменения степеней окисления серы в приведенных реакция.
1. +4 (-2е) → +6
2. -2 (-6е) → +4
3. -2 (-2е) → 0
4. 0 (+2е) → -2
То есть сера принимает электроны в последней реакции. Правильный ответ - 4.
Задание №15.
Массовая доля кальция в карбонате кальция равна:
1. 0,8
2. 0,4
3. 0,2
4. 0,6
Объяснение: рассчитаем массовую долю кальция по формуле:
ω = (Ar(Ca) x n)/Mr, где n - количество атомов кальция в молекуле.
ω(Ca) = 40/100 = 0,4
Правильный ответ - 2.
Задание №16.
Общим для магния и цинка является
1. Наличие одинакового числа электронных слоев в их атомах
2. Наличие двух электронов на внешнем электронном слое в их атомах
3. Образование ими высших оксидов, которые относятся к основным оксидам
4. То, что они являются восстановителями в реакциях с неметаллами
5. То, что их оксиды хорошо растворяются в воде
Объяснение: магний находится в третьем периоде, во второй А группе и является щелочноземельным металлом, цинк находится в четвертом периоде, второй В группе и является переходным металлом, то есть эти два элемента имею разное количество электронных слоев. Но количество электронов на внешнем уровне у них одно и то же - 2. Оксид цинка является амфотерным, а не основным. А в реакциях с неметаллами являются восстановителями, так как отдают электроны. Их оксиды не растворяются в воде. Правильный ответ - 24.
Задание №17.
Для этана характерны следующие утверждения
1. Обесцвечивает бромную воду
2. Вступает в реакцию дегидрирования
3. Атомы углерода в молекуле соединены одинарными связями
4. В состав молекулы входит один атом углерода
5. Относится к кислородсодержащим органическим веществам
Объяснение: этан - предельный углеводород, то есть для него характерны, в основном, реакции замещения. А еще он может дегидрироваться, превращаясь в этилен или ацетилен. Правильный ответ - 23.
Задание №18.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества
Вещества
1. SO3(г) и O2(г)
2. HNO3(р-р) и NH3(р-р)
3. BaCO3(тв) и BaO(тв)
Реактив
1. Na2SO4(р-р)
2. Ca(OH)2(р-р)
3. Фенолфталеин
4. HCl(р-р)
Объяснение: первые два газа можно различить в реакции с гидроксидом кальция: оксид серы будет образовывать соль - сульфат кальция, а кислород реагировать не будет. Растворы азотной кислоты и аммиака можно различить при помощи индикатора - фенолфталеина, он будет давать разную окраску: в кислой среде он будет бесцветный, а в слабо-щелочной - розовый. Правильный ответ - 234.
Задание №19.
Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать
Название вещества
А. Сероводород
Б. Оксид серы (VI)
В. Оксид серы (IV)
Реагенты
1. O2, KOH(р-р)
2. Hg, H2O
3. O2, Cu
4. H2O, CaO
Объяснение: сероводород реагирует с кислородом (при недостатке кислорода образуется сера и вода, а при избытке кислорода образуется оксид серы (IV)) и с гидроксидом калия (с образованием сульфида калия и воды). С этими же реагентами реагирует оксид серы (IV). А оксид серы (VI) реагирует с водой с образованием серной кислоты и с оксидом кальция с образованием сульфата кальция. Правильный ответ - 141.
Задание №20.
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
K2MnO4 + HCl(конц) → MnCl2 + KCl + Cl2 + H2O
Определите окислитель и восстановитель.
Объяснение: в данной реакции меняют степень окисления - марганец и хлор.
Запишем баланс:
Mn(+6) +4e → Mn(+2) | 1 - окислитель
2Cl(-1) -2e → Cl2(0) | 2 - восстановитель
Расставим коэффициенты.
K2MnO4 + 8HCl(конц) → MnCl2 + 2KCl + 2Cl2 + 4H2O
Задание №21.
К 400 г раствора силиката калия добавили избыток раствора серной кислоты и получили 19,5 г осадка. Какова массовая доля соли (в %) в исходном растворе?
Объяснение: запишем реакцию.
K2SiO3 + H2SO4 → H2SiO3↓ + K2SO4
Рассчитаем количество вещества кремниевой кислоты.
n(H2SiO3) = 19,5/(2+28+48) = 0,25 моль
n(H2SiO3) = n(K2SiO3) = 0,25 моль
Рассчитаем массу вещества силиката калия.
M(K2SiO3) = 39x2 + 28 + 48 = 154 г/моль
m(K2SiO3) = 0,25 x 154 = 38,5 г
ω(K2SiO3) = 38,5/400 x 100% = 9,625%
Ответ: массовая доля соли в исходном растворе равна 9,625%.
Задание №22.
Даны вещества: ZnSO4, HNO3(конц), Hg, Cu, I2, KOH. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид меди (II). Опишите признаки проведения реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Объяснение: допустим медь прореагирует с концентрированной азотной кислотой.
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2↑ + 2H2O
А затем нитрат меди прореагирует с гидроксидом калия, при этом образуется нерастворимый гидроксид меди.
Cu(NO3)2 + KOH = KNO3 + Cu(OH)2↓
