
Вариант 5
Задание №1.
На приведенном рисунке
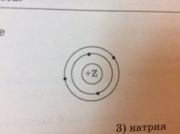
изображена модель атома
1. Бериллия
2. Гелия
3. Натрия
4. Лития
Объяснение: у атома элемента, схема которого приведена на рисунке, два электронных слоя, на первом слое два электрона и на втором тоже 2. Значит это элемент с порядковым номером 4, а это - бериллий. Правильный ответ - 1.
Задание №2.
Основным является высший оксид каждого из химических элементов, имеющих в периодической системе Д.И. Менделеева порядковые номера:
1. 11, 7, 16
2. 19, 15, 17
3. 12, 3, 20
4. 6, 14, 16
Объяснение: основными оксидами являются оксиды щелочных и щелочноземельных металлов. Свойства основных оксидов можно посмотреть здесь. Из перечисленных выбираем магний, литий и кальций. Правильный ответ - 3.
Задание №3.
Ковалентной неполярной связью образовано каждое из веществ, формулы которых:
1. Br2, H2, O2
2. O2, S8, H2S
3. O2, H2, H2O
4. CO, CH4, H2
Объяснение: ковалентная неполярная связь образуется между атомами одного и того же элемента, поэтому выбираем бром, водород и кислород. Правильный ответ - 1.
Задание №4.
Отрицательная степень окисления химических элементов численно равна:
1. Номеру группы в периодической системе
2. Числу электронов, недостающих до завершения внешнего электронного слоя
3. Числу электронных слоев в атоме
4. Номеру периода, в котором находится элемент в периодической системе
Объяснение: отрицательная степень окисления показывает сколько электронов не хватает атому до заполнения электронного слоя, так как отрицательная степень окисления - это наличие электронов (ситуация, при которой атом электроны забрал). Правильный ответ - 2.
Задание №5.
К сложным веществам относится:
1. Красный фосфор
2. Алмаз
3. Воздух
4. Угарный газ
Объяснение: сложные вещества состоят из атомов двух или более элементов. Красный фосфор и алмаз - простые вещества, воздух - смесь газов, угарный газ - сложное вещество - СО. Правильный ответ - 4.
Задание №6.
Реакции замещения соответствует уравнение:
1. 2NaOH + CO2 = Na2CO3 + H2O
2. NaCl + AgNO3 = NaNO3 + AgCl
3. CuO + H2SO4 = CuSO4 + H2O
4. Fe2O3 + 3C = 2Fe + 3CO
Объяснение: реакция замещения - реакция при которой одни атомы или функциональные группы меняются на другие. Из приведенных, реакцией замещения является последняя, в ней углерод замещает железо в оксиде. Правильный ответ - 4.
Задание №7.
Верны ли следующие суждения об электролитической диссоциации солей?
А. Все соли при диссоциации образуют катионы металлов, катионы водорода и анионы кислотных остатков.
Б. Соли в процессе диссоциации образуют катионы металлов и анионы кислотных остатков.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: первое утверждение неверно, так как катионы металлов, катионы водорода и анионы кислотных остатков при диссоциации дают только кислые соли. А второе утверждение верно. Правильный ответ - 2.
Задание №8.
Осадок белого цвета, нерастворимый в кислотах и щелочах, образуется в результате реакции, сокращенное ионное уравнение которой:
1. Zn²+ + 2OH‾ = Zn(OH)2
2. Fe²+ + 2OH‾ = Fe(OH)2
3. Ca²+ + CO3²‾ = CaCO3
4. Ba²+ + SO4²‾ = BaSO4
Объяснение: карбонат кальция растворяется в кислотах, гидроксиды образуют комплексы в щелочах. Сульфат бария нерастворим ни в кислотах ни в щелочах. Правильный ответ - 4.
Задание №9.
Цинк вытесняет металл из раствора:
1. Нитрата кальция
2. Нитрата калия
3. Нитрата меди (II)
4. Сульфата алюминия
Объяснение: цинк может вытеснить только менее активный металл. Среди кальция, калия, меди и алюминия слабее цинка только медь (см. ряд напряжений металлов). Правильный ответ - 3.
Задание №10.
Верны ли следующие суждения об оксидах?
А. При взаимодействии кислотных оксидов с основными образуются соли.
Б. Оксид серы (VI) реагирует как с гидроксидом натрия, так и с оксидом калия.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: оба суждения верны, такой вывод можно сделать, вспомнив химические свойства оксидов. Правильный ответ - 3.
Задание №11.
Раствор серной кислоты не взаимодействует с веществом, формула которого:
1. CuO
2. Cu
3. Ca(OH)2
4. Ba(NO3)2
Объяснение: раствор серной кислоты, как и все кислоты (кроме азотной) не реагирует с металлами, стоящими в ряду напряжений металлов после водорода. Таким металлом является медь. Правильный ответ - 2.
Задание №12.
Химическая реакция возможна между солями:
1. Na2CO3 и KCl
2. Al2(SO4)3 и NaNO3
3. AlCl3 и K2SO4
4. AgNO3 и Na3PO4
Объяснение: реакция обмена возможна только при образовании газа или осадка. Осадком является фосфат серебра, образующийся в последней реакции. Запишем ее.
3AgNO3 + Na3PO4 = 3NaNO3 + Ag3PO4↓
Правильный ответ - 4.
Задание №13.
Верны ли следующие суждения об обращении с газами в процессе лабораторных опытов?
А. Полученный из перекиси водорода кислород нельзя определять по запаху.
Б. Водород, полученный в аппарате Киппа, не надо проверять на чистоту.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: кислород (как и все остальные газы) в лаборатории нельзя проверить по запаху, так как кислород запаха не имеет. Водород всегда нужно проверять на чистоту вне зависимости от способа получения. Правильный ответ - 4.
Задание №14.
В химической реакции, уравнение которой
2KI + SO3 = K2SO3 + I2
окислителем является
1. I‾ в иодиде калия
2. О²‾ в оксиде серы (VI)
3. К+1 в иодиде калия
4. S+6 в оксиде серы (VI)
Объяснение: в данной окислительно-восстановительной реакции йод и сера меняют степень окисления. Запишем баланс.
S(+6) +2e → S(+4) - окислитель
2I(-1) -2e → I2(0) - восстановитель
То есть, окислителем является сера в оксиде серы (VI).
Правильный ответ - 4.
Задание №15.
Какое распределение массовых долей элементов соответствует количественному составу гидроксида калия?
1. 28,5,1,5, 70
2. 28,5, 3,5 67
3. 43, 3, 54
4. 42, 5, 53
Объяснение:
Ar(K) = 39 г/моль
Ar(H) = 1 г/моль
Ar(O) = 16 г/моль
Mr(KOH) = 56 г/моль
ω(К) = 39/56 х 100% = 70%
ω(Н) = 1/56 х 100% = 1,8%
ω(О) = 16/56 х 100% = 28,2%
Правильный ответ - 1.
Задание №16.
Общим для хлора и брома является
1. Наличие на внешнем электронном слое одинакового числа электронов
2. Наличие четырех электронных слоев в атомах
3. Одинаковое физическое состояние образованных ими простых веществ
4. Образование ими высших оксидов с общей формулой Э2О7
5. То, что они являются более сильными окислителями, чем фтор
Объяснение: и хлор и бром находятся в седьмой группе и называются галогенами, то есть на внешнем электронном слое оба элемента имеют одинаковое количество электронов - 7. В простом состоянии хлор является газом, бром - жидкостью. Оба образуют высшие оксиды с формулой Э2О7. Фтор является более сильным окислителем, чем оба эти галогена. Правильный ответ - 1.
Задание №17.
Для стеариновой кислоты характерны следующие утверждения
1. Хорошо растворяется в воде
2. Относится к кислородсодержащим органическим соединениям
3. Изменяет окраску лакмуса
4. Не содержит функциональных групп
5. Взаимодействует с кислородом
Объяснение: формула стеариновой кислоты - С8Н36О2, относится к карбоновым кислотам, то есть имеет функциональную группу - карбоксильную. Нерастворима в воде. Вступает в реакцию горения с кислородом (реакция идет до углекислого газа и воды). Правильный ответ - 25.
Задание №18.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти свойства.
Вещества
А. K2CO3(р-р) и Na2SiO3(р-р)
Б. Na2CO3(тв) и CaCO3(тв)
В. K2SO4(р-р) и KOH(р-р)
Реактив
1. CuCl2(р-р)
2. HNO3(р-р)
3. MgO
4. H2O
Объяснение: карбонат калия и силикат натрия можно различить при помощи азотной кислоты, в первой реакции выделяется углекислый газ. Твердые карбонат натрия и карбонат кальция различим водой, потому что карбонат натрия растворим в воде, а карбонат кальция - нерастворим (белый осадок). Сульфат калия и гидроксид калия отличить друг от друга можно при помощи раствора хлорида меди, так как образующийся во второй реакции гидроксид меди синего цвета и нерастворим в воде. Правильный ответ - 241.
Задание №19.
Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
Название вещества
А. Оксид углерода (II)
Б. Оксид углерода (IV)
В. Карбонат натрия
Реагенты
1. Ba(OH)2(р-р), Mg
2. CO2(р-р), HCl(р-р)
3. Fe2O3, O2
4. H2O, SO2
Объяснение: оксид углерода (II) реагирует с оксидом железа и кислородом. Магний горит в углекислом газе: 2Мg + CO2 = C + 2MgO и еще диоксид углерода реагирует с гидроксидом бария. CO2 + Ba(OH)2 = BaCO3 + H2O
Карбонат натрия вступает в реакцию с углекислым газом и соляной кислотой.
Правильный ответ - 312.
Задание №20.
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
H2S + HClO3 → S + HCl + H2O
Определите окислитель и восстановитель.
Объяснение: сера и хлор меняют степень окисления в данной окислительно-восстановительной реакции. Запишем баланс.
S(-2) -2e → S(0) | 3 - восстановитель
Cl(+5) +6e → Cl(-1) | 1 - окислитель
Расставляем коэффициенты.
3H2S + HClO3 → 3S + HCl + 3H2O
Задание №21.
Определите объем (н.у.) оксида углерода (IV), образующегося при растворении 110 г известняка, содержащего 92% карбоната кальция, в избытке соляной кислоты.
Объяснение: запишем уравнение реакции.
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
Найдем массу чистого известняка.
m(СaCO3) = 110 x 0,92 = 101,2 г
Находим количество вещества карбоната кальция.
n(CaCO3) = 101,2/100 = 1 моль
Количество вещества карбоната кальция равно количеству вещества углекислого газа.
n(CaCO3) = n(CO2) = 1 моль
Найдем объем углекислого газа.
V(CO2) = 1 x 22,4 = 22,4 л
Ответ: объем углекислого газа равен 22,4 л.
Задание №22.
Даны вещества: Al, I2, NaI, NaOH, HNO3. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид алюминия. Опишите признаки проведения реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Объяснение: алюминий реагирует с йодом: 2Al + 3I2 → 2AlI3
Затем йодид алюминия реагирует с гидроксидом натрия, при этом образуется нерастворимый гидроксид алюминия: AlI3 + 3NaOH → 3NaI + Al(OH)3↓
Запишем сокращенное ионное уравнение.
Al³+ + OH‾ → Al(OH)3↓
